除鐵除錳常規水處理工藝介紹
2025-05-10 來自: 衡美水處理公眾平臺 瀏覽次數:74
衡美水處理為您介紹一項水處理專業知識——除鐵除錳的常規水處理工藝介紹。
含鐵、含錳的地下水在我國分布很廣,鐵和錳可以共存于地下水中,并常以溶解度較高的二價鐵、二價錳形式存在。
水中富含的鐵離子會使水發黃,有明顯的鐵銹氣味,易使衣服和器皿著色發黃,還易促進管網中鐵細菌的生長,對生活、生產用水造成污染,對管路造成損害。另外,鐵含量高的水進入鍋爐和換熱設備,易結生氧化鐵垢和垢下腐蝕;鐵含量較高的原水進入離子交換器,易使樹脂中毒。
錳是人體及動植物所需的微量元素之一,但攝入過量的錳會引起中毒,長期接觸錳化合物也可造成錳中毒。含錳水會使水有色、臭、味,影響紡織、造紙、釀造、食品等工業產品質量,也會對家用器具造成污染,洗滌衣物會有微黑色或淺灰色的斑漬。
含鐵錳的地下水暴露在空氣中一段時間后,沉淀出棕黃色沉淀物
富含鐵、錳離子的水對人類生活、工農業生產會造成較大危害,因此需要經過處理后方可使用。
一、除鐵
地下水中的二價鐵不穩定,常使用曝氣法去除。地下水中二價鐵鹽通常以重碳酸鐵Fe(HCO3)2的形式存在。一般是將地下水通過水泵抽入曝氣池中,并在輸水管路或曝氣池中通入壓縮空氣或通過射流法在管路中混入空氣,從而使空氣中的氧氣與水充分混合,達到將二價鐵氧化成三價鐵的目的;再通過錳砂或其他除錳濾料過濾,去除氧化鐵沉淀物。
錳砂(主要成分是二氧化錳)是二價鐵氧化成三價鐵的良好催化劑。當pH值大于5.50時(一般應保持原水pH值為6.5-7.0可取得較好的處理效果),能加速二價鐵氧化成三價鐵的過程。其化學反應方程式如下:
4Fe2++O2+8OH-+2H2O → 4Fe(OH)3↓
氧化過程中,水中須保持足夠的溶解氧,才能將二價鐵氧化成三價鐵,并在水解后呈膠體氫氧化鐵以褐色絮狀物沉淀,可經錳砂濾層過濾將鐵除去。
二、除錳
氧化除錳基本與除鐵一樣,含錳水經曝氣后經過錳砂濾料,在錳砂濾料表面的錳質活性濾膜作用下,Mn2+被溶解氧氧化為MnO2,吸附在濾料表面,使濾膜得到更新,該過程也是自催化反應。其反應式為:
2Mn2++O2+4OH- → 2MnO2↓+2H2O
水中的二價錳鹽在過濾時,也可能因MnO吸附而發生下列化學反應:
MnO2 ·H2O+Mn2++2OH- → MnO2 ·MnO·H2O+H2O
注:MnO2 ·H2O指有效錳砂;MnO2 ·MnO·H2O指失效錳砂。
錳砂與Mn2+結合生成三氧化二錳后,便失去了除錳的性能。需要加入氧化劑再生。 使MnO2 ·MnO重新氧化成MnO2。一般生產中多采用往水中加氯(Cl2)的方法,來恢復錳砂的除錳性能。其反應式為:
MnO2 ·MnO·H2O+2H2O+Cl2 → 2MnO2 ·H2O+2HCl
錳的去除遠比除鐵困難,鐵、錳共存時,鐵對錳的去除有干擾。在濾層中,要先完成對鐵的去除,才能開始除錳,因此要獲得穩定的除錳效果,Fe2+的濃度不應超過2mg/L。
三、鐵錳共存的去除方法
當原水中鐵錳含量較高,含Fe量超過5mg/L、含錳量超過1.5mg/L時,若用錳砂同時進行處理,由于鐵比錳易于氧化,二價錳較難被氧化為四價錳。因此,一般需要采用二次過濾法,即先除鐵,使Fe2+的濃度低于2mg/L,再除錳。其流程為:地下水→深井泵(變頻泵)→曝氣→一 級過濾(除鐵)→二級過濾(除錳)。
當原水中鐵錳含量較低,含鐵量低于5mg/L、含錳量低于1.5mg/L時,可以采用一次過濾去除。其流程為:地下水→深井泵(變頻泵)→曝氣→過濾(同時除鐵除錳)。
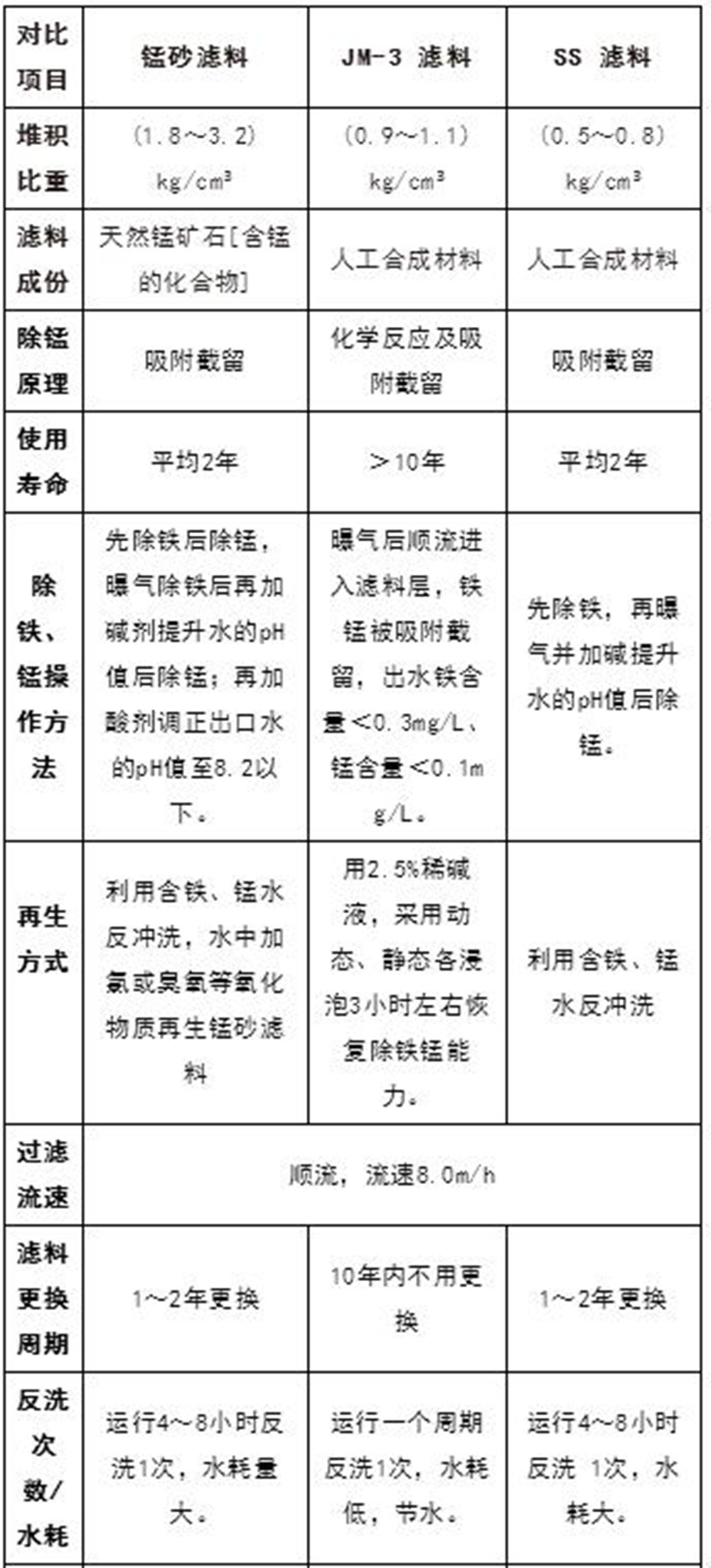
目前國內常用除鐵錳的濾料有:錳砂、SS濾料、人工合成的分子篩“JM-3型”濾料,主要是采用化學反應和吸附截留的原理來實現。
錳砂主要是利用表面的錳質活性濾膜MnO2進行除錳;
SS濾料是一種含硅、鐵、鋁的多孔狀顆粒濾料,具有良好的過濾、吸附和絮凝沉淀作用;
JM-3型濾料是一種硅、鋁、氧的晶格狀四面體,其采用吸附與離子交換兩種方式去除。
JM-3除鐵錳濾料中的硅與鋁交換,而鋁是三價、硅是四價,缺少一個電荷,需要正電荷的離子補充。當水與JM-3濾料接觸時,水中帶正電荷的離子可補充JM-3濾料中缺少的電荷,從而被濾料吸附,達到凈水的目的。它可以有效地去除水中絕大部分無機鹽類和部分有機物,去除率在70%~90%,特別是處理毒理學物質中的氟、砷、汞、鉛、鎘、硒、鉬以及鐵、錳、鋅、鈣、鎂等,效果顯著。

實現城市用水潔凈處理,營造和諧人居生活環境。








